Soluzioni e concentrazioni
Panoramica
Fonte: Laboratorio del Dr. Michael Evans — Georgia Institute of Technology
Una soluzione è una miscela omogenea contenente alcuni componenti in piccole quantità, chiamati soluti, e un componente in grande quantità, chiamato solvente. Le soluzioni solido-liquide contengono uno o più soluti solidi disciolti in un solvente liquido. Le soluzioni sono onnipresenti in chimica: vengono utilizzate per immagazzinare e gestire piccole quantità di materiale, effettuare reazioni chimiche e sviluppare materiali con proprietà controllabili.
La densità di un soluto in una soluzione è nota come concentrazione del soluto. La concentrazione può essere espressa in diversi modi, differendo nelle unità utilizzate per convogliare le quantità di soluto, solvente e soluzione.
Questa dimostrazione illustra come preparare una soluzione di saccarosio con una concentrazione target utilizzando tecniche analitiche precise. Inoltre, vengono presentate e spiegate varie misure della concentrazione di questa soluzione.
Principi
Quando vengono immersi in acqua, molti solidi si rompono in particelle (molecole o ioni) circondate da molecole d'acqua. Questo processo di dissoluzione converte una miscela eterogenea di solido e liquido in un'unica miscela omogenea costituita da acqua liquida e particelle di soluto disciolte. Il processo di dissoluzione per il saccarosio può essere scritto come un'equazione chimica usando i designatori di fase solida e acquosa. Il designatore (aq) che segue una specie implica che le molecole d'acqua circondano e solvano quella specie.

Soluzioni diverse possono contenere un numero diverso di particelle disciolte e la concentrazione è una misura che quantifica la densità delle particelle di soluto all'interno di una soluzione. Una misura fondamentale della concentrazione è la frazione molare (x) del soluto: il numero di moli di particelle di soluto (nsoluto) diviso per il numero totale di moli dei componenti della soluzione (tutti i soluti e solvente).

Moltiplicando la frazione molare per 106 si ottiene la concentrazione di parti per milione (ppm), il numero di particelle di soluto per milione di particelle di soluzione. Il numero di moli di soluto per litro di soluzione, o molarità (M), è una seconda misura comune di concentrazione.
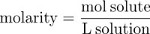
La concentrazione può anche essere espressa come parti per massa, la frazione della massa della soluzione dovuta al soluto.
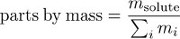
Moltiplicando le parti per la concentrazione di massa per il 100% si ottiene la percentuale di massa.
Infine, la molalità è una misura di concentrazione che utilizza la massa del solvente, piuttosto che il volume della soluzione, come misura della "dimensione" della soluzione. La molalità è il rapporto tra il numero di moli di soluto e la massa del solvente in chilogrammi.
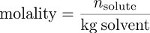
La preparazione precisa e accurata di una soluzione con una molarità target richiede un'attenta tecnica analitica. Il soluto solido deve essere accuratamente pesato e trasferito quantitativamente (completamente) in un matraccio volumetrico. Il solvente può quindi essere aggiunto con attenzione fino a quando la soluzione raggiunge il segno sulla vetreria. Per ottenere i migliori risultati, il soluto deve essere lasciato sciogliere completamente in meno del volume totale di solvente e qualsiasi solvente rimanente deve essere aggiunto quando non è visibile alcun soluto solido.
Procedura
1. Preparazione di 100 mL di una soluzione di saccarosio 0,0100 M
- Determinare il numero di moli e la massa di saccarosio (C12H22O11) da sciogliere in 100 mL di soluzione.
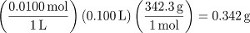
- Pesare la massa di saccarosio sulla bilancia. Per prima cosa metti una barca pesata sulla bilancia e imposta la "tara". Quindi, utilizzando una scoopula, trasferire con cura il soluto solido dal flacone del reagente alla barca di pesatura fino a ottenere la quantità desiderata.
- Posizionare un imbuto di polvere in un matraccio volumetrico da 100 ml pulito e asciutto. Versare il solido dalla barca di pesatura attraverso l'imbuto nel pallone.
- Utilizzando un flacone di lavaggio contenente acqua distillata (il solvente), sciacquare il solido residuo dalla barca di pesatura attraverso l'imbuto nel pallone.
- Aggiungere il solvente utilizzando il rubinetto dell'acqua distillata fino a quando il livello del liquido raggiunge il collo del pallone (ma non il segno). Tappare e ruotare delicatamente il pallone per sciogliere il soluto.
- Una volta che tutto il soluto si è sciolto, utilizzare un flacone di lavaggio per aggiungere con cura il solvente fino a quando il livello del liquido raggiunge il segno.
- Tappare e invertire più volte il matraccio volumetrico per garantire una buona miscelazione della soluzione.
2. Fare una soluzione di saccarosio supersaturo
- Aggiungere 100 ml di acqua distillata a un becher da 600 ml.
- Aggiungere 220 g di saccarosio al becher.
- Mettere una barra magnetica nel becher e lasciare che la miscela si mescoli per 15 minuti.
- Esaminare la miscela: non tutto il saccarosio si è sciolto. Riscaldare la miscela a 50 ºC e mescolare per altri 10 minuti.
- Esaminare la miscela: tutto il saccarosio si è sciolto a 50 ºC.
- Lasciare raffreddare la soluzione a temperatura ambiente. Esaminare la soluzione: il saccarosio aggiuntivo disciolto a 50 ºC rimane disciolto a temperatura ambiente. La soluzione a temperatura ambiente è supersatura.
Risultati
La fase 1 della procedura crea 100 mL di una soluzione di saccarosio 0,0100 M. Per convertire in misure di concentrazione diverse dalla molarità, determinare la massa d'acqua utilizzata per preparare la soluzione. Sebbene questo possa essere misurato con precisione, in assenza di una misurazione si può presumere che il volume delle particelle di soluto disciolte sia trascurabile (cioè, il volume di acqua utilizzato era di 100 ml). Usando la densità dell'acqua...

La molalità del saccarosio in questa soluzione è quindi:
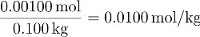
Le parti in massa di saccarosio sono pari a:
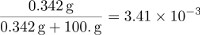
La frazione molare del saccarosio può essere calcolata determinando il numero di moli in 100 g di acqua e dividendo la quantità di saccarosio per la quantità totale di particelle nella soluzione.

La fase 2 della procedura illustra che la solubilità del saccarosio in acqua dipende dalla temperatura. Al riscaldamento, il saccarosio non disciolto che riposa in una soluzione satura si dissolve, formando una soluzione satura di concentrazione più elevata a temperature più elevate. Quando questa soluzione si raffredda, il saccarosio non precipita fuori dalla soluzione. La soluzione raffreddata risultante è sovrasatura con saccarosio. L'aggiunta anche di una piccola quantità di polvere di saccarosio aggiuntiva in questa soluzione può innescare una rapida ricristallizzazione di tutto il saccarosio disciolto.
Applicazione e Riepilogo
Le soluzioni solido-liquido sono onnipresenti in chimica. La maggior parte delle reazioni chimiche vengono eseguite in soluzione perché i soluti disciolti sono abbastanza mobili da mescolarsi rapidamente e urtarsi l'uno con l'altro. Le soluzioni possono anche essere utilizzate per immagazzinare piccole quantità di soluti in volumi macroscopici e facilmente gestibili. Le soluzioni mostrano alcune interessanti proprietà fisiche chiamate proprietà colligative che possono essere attribuite agli effetti entropici della dissoluzione di un soluto in un solvente.
Ci si potrebbe chiedere perché esistano così tante diverse misure di concentrazione della soluzione. La risposta sta nelle molte applicazioni delle soluzioni e nei molti ordini di grandezza su cui si estendono le concentrazioni. Nei campioni di acqua proveniente dall'ambiente, ad esempio, le concentrazioni di ioni metallici possono essere nell'intervallo di poche parti per milione - è poco pratico e potenzialmente fuorviante esprimere questa piccola concentrazione come molarità o frazione molare. Sebbene la molarità sia una misura conveniente della concentrazione per i calcoli stechiometrici che coinvolgono reazioni chimiche, la molalità è più appropriata negli studi di alcune proprietà colligative.
Perfezionare la tecnica di preparazione della soluzione è importante, perché in molti contesti è essenziale una conoscenza precisa della concentrazione. Quando si esegue una reazione chimica, ad esempio, l'uso di troppo o troppo poco soluto potrebbe comportare reagenti sprecati o basse rese di prodotto. Gli studi sulle relazioni empiriche che coinvolgono la concentrazione, come la legge di Beer, dipendono da concentrazioni note con precisione. Spesso, l'imprecisione nelle concentrazioni della soluzione porta direttamente all'incertezza nei valori calcolati, come le entalpie di reazione. Sebbene sia impossibile eliminare completamente l'imprecisione, l'uso di tecniche analitiche per la creazione di soluzioni garantisce che l'incertezza sia ridotta al minimo.
Vai a...
Video da questa raccolta:

Now Playing
Soluzioni e concentrazioni
General Chemistry
275.8K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
659.9K Visualizzazioni

Determinazione della densità di un solido e di un liquido
General Chemistry
557.3K Visualizzazioni

Determinazione della composizione percentuale di massa in una soluzione acquosa
General Chemistry
384.0K Visualizzazioni

Determinazione della formula empirica (minima)
General Chemistry
183.9K Visualizzazioni

Determinazione delle regole di solubilità di composti ionici
General Chemistry
141.7K Visualizzazioni

Uso del pH-metro
General Chemistry
347.2K Visualizzazioni

Introduzione alla titolazione
General Chemistry
425.9K Visualizzazioni

Legge dei gas perfetti
General Chemistry
79.5K Visualizzazioni

Determinazione spettrofotometrica di una costante di equilibrio
General Chemistry
158.9K Visualizzazioni

Principio di Le Châtelier
General Chemistry
266.1K Visualizzazioni

Depressione del punto di congelamento per l'identificazione di un composto sconosciuto
General Chemistry
161.0K Visualizzazioni

Determinazione dell'equazione cinetica e dell'ordine di reazione
General Chemistry
196.5K Visualizzazioni

Utilizzo della calorimetria a scansione differenziale per misurare cambiamenti nell'entalpia
General Chemistry
44.8K Visualizzazioni

Complessi chimici di coordinazione
General Chemistry
91.8K Visualizzazioni